Avant de répondre à la question posée dans le titre de l'article, voyons ce que c'est. Les images qui apparaissent chez la plupart des gens avec ce mot: une bouilloire ou une casserole en ébullition, un hammam, une boisson chaude et de nombreuses autres images similaires. En tout cas, dans nos idées, il y a un liquide et une substance gazeuse s'élevant au-dessus de sa surface. Si on vous demande de donner un exemple de vapeur, vous vous souviendrez immédiatement de la vapeur d'eau, des vapeurs d'alcool, de l'éther, de l'essence, de l'acétone.

Il existe un autre mot pour les états gazeux -gaz . Ici, nous rappelons généralement l'oxygène, l'hydrogène, l'azote et d'autres gaz, sans les associer aux liquides appropriés. Il est bien connu qu’ils existent à l’état liquide. À première vue, la différence réside dans le fait que la vapeur correspond aux liquides naturels et que les gaz doivent être spécifiquement liquéfiés. Cependant, ce n'est pas tout à fait vrai. De plus, les images issues du mot vapeur - vapeur ne le sont pas. Pour donner une réponse plus précise, voyons comment naît la vapeur.
En quoi la vapeur diffère-t-elle du gaz?
L'état global d'une substance est déterminé par la température, plus précisément par le rapport entre l'énergie avec laquelle ses molécules interagissent et l'énergie de leur mouvement chaotique thermique. Approximativement, nous pouvons supposer que si l’énergie d’interaction est beaucoup plus grande - un état solide, si l’énergie du mouvement thermique est beaucoup plus grande - gazeuse, si une énergie comparable est - liquide.
Molécule de gaz
Il s'avère que la molécule pourrait se détacher deliquide et participent à la formation de vapeur, la quantité d’énergie thermique doit être supérieure à l’énergie d’interaction. Comment cela peut-il arriver? Le taux moyen de mouvement thermique des molécules est égal à une certaine valeur, en fonction de la température. Cependant, les vitesses individuelles des molécules sont différentes: la plupart d'entre elles ont des vitesses proches de la valeur moyenne, mais certaines d'entre elles ont des vitesses supérieures à la moyenne, d'autres moins.
Les molécules plus rapides peuvent avoir une énergie thermique supérieure à l’énergie d’interaction. Par conséquent, une fois à la surface du liquide, elles sont capables de s’en détacher pour former de la vapeur. Cette méthode de vaporisation est appeléeévaporation . En raison de la même distribution de vitesse, il existe un processus opposé - condensation: les molécules de la vapeur passent dans le liquide. En passant, les images qui apparaissent généralement lorsque les paires de mots ne sont pas de la vapeur, mais le résultat du processus opposé - la condensation. La vapeur ne peut pas être vu.

Évaporation
Dans certaines conditions, la vapeur peut devenir un liquide, mais sa température ne doit pas dépasser une certaine valeur. Cette valeur s'appelle la température critique. La vapeur et le gaz sont des états gazeux caractérisés par la température à laquelle ils existent. Si la température ne dépasse pas le seuil critique - la vapeur, si elle dépasse - le gaz. Si la température est maintenue constante et que le volume est réduit, la vapeur est liquéfiée, le gaz n'est pas liquéfié.
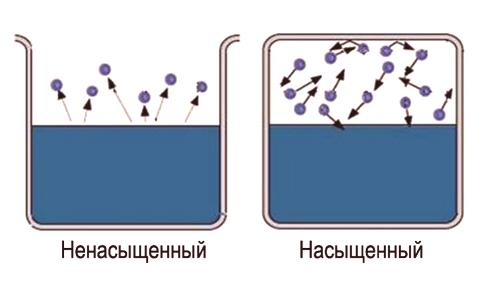
Qu'est-ce que la vapeur saturée et non saturée
Le mot "saturé" porte lui-même une certainel'information est difficile à saturer une grande surface de l'espace. Donc, pour obtenir de la vapeur saturée, il est nécessairede limiter l'espace dans lequel se trouve le liquide . La température doit être moins critique pour cette substance. Maintenant, les molécules évaporées restent dans l'espace où se trouve le liquide. Premièrement, la plupart des transitions moléculaires se produiront à partir du liquide, tandis que la densité de vapeur augmentera. Cela entraînera à son tour un plus grand nombre de transitions inverses de molécules dans un liquide, ce qui augmentera la vitesse du processus de condensation.
Enfin, un état est établi pour lequel le nombre moyen de molécules passant d'une phase à une autre sera égal. Cet état s'appellel'équilibre dynamique . Cet état est caractérisé par le même changement dans la magnitude et la direction des taux d'évaporation et de condensation. Cet état correspond à une paire saturée. Si l'état d'équilibre dynamique n'est pas atteint, cela correspond à un couple non saturé.
Commencez l'étude d'un objet, toujours avec son modèle le plus simple. Dans une théorie cinétique moléculaire, il s'agit d'un gaz idéal. Les principales simplifications sont la négligence du volume des molécules et de l’énergie de leur interaction. Il s'avère qu'un tel modèle décrit de manière tout à fait satisfaisante la vapeur insaturée. Et moins elle est saturée, plus son application est légitime. Un gaz idéal est un gaz, il ne peut devenir ni vapeur ni liquide. Par conséquent, pour la vapeur saturée, ce modèle n’est pasadéquate.
Les principales différences entre vapeur saturée et vapeur insaturée
- Saturé signifie que l'objet a la plus grande valeur possible de certains paramètres. Pour la vapeur, il s'agit dedensité et de pression . Ces paramètres pour la vapeur non saturée ont des valeurs plus petites. Plus la vapeur est loin de la saturation, plus ces valeurs sont petites. Une précision: la température de référence doit être constante.
- Pour une vapeur non saturée, laloi de Boyle-Mariotteest satisfaite: si la température et la masse du gaz sont constantes, une augmentation ou une diminution de volume entraîne une diminution ou une augmentation de pression du même montant, la pression et le volume sont inversement proportionnels. De la densité maximale et de la pression à température constante, leur indépendance par rapport au volume de vapeur saturée s'en suit: il s'avère que pour la vapeur saturée, la pression et le volume ne dépendent pas l'un de l'autre.
- Pour la vapeur non saturée , la densité ne dépend pas de la températureet, si le volume est préservé, la valeur de la densité ne change pas non plus. Pour la vapeur saturée, tout en maintenant le volume, la densité change si la température change. La dépendance dans ce cas est directe. Si la température augmente, la densité augmente, si la température diminue, la densité change également.
- Si le volume est constant, la vapeur insaturée se comporte conformément à la loi de Charles: à mesure que la température augmente, la pression augmente de la même quantité. Une telle relation s'appelle linéaire. À la vapeur saturée avec une pression de température croissantemonte plus vite que la vapeur insaturée. La dépendance est exponentielle.
En résumé, nous pouvons noter des différences significatives dans les propriétés des objets comparés. La principale différence est que la vapeur saturée ne peut être considérée isolément de son liquide. Il s’agit d’un système à deux composants auquel la plupart des lois sur les gaz ne peuvent pas être appliquées.






