Le concept de molécule (et les idées sur la structure moléculaire d'une substance, la structure de la molécule elle-même) qui en découle permet de comprendre les propriétés des substances qui créent le monde. Les études physico-chimiques modernes, ainsi que les études antérieures, sont basées sur la découverte à grande échelle de la structure atomique-moléculaire de la matière. La molécule est un «détail» unique de toutes les substances, dont l'existence a été suggérée par Démocrite. C'est donc précisément sa structure et son interrelation avec d'autres molécules (formant une certaine structure et composition) qui détermine /explique toutes les différences entre les substances, leur type et leurs propriétés.
La molécule elle-même, n'étant pas le plus petit constituant d'une substance (qui est un atome), a une certaine structure, des propriétés. La structure de la molécule est déterminée par le nombre d'atomes définis dans celle-ci et par la nature de la liaison (covalente) entre eux. Cette composition est inchangée, même si la substance est convertie dans un autre état (par exemple, cela se produit avec de l'eau - cela sera discuté plus loin).
La structure moléculaire d'une substance est fixée par une formule donnant des informations sur les atomes, leur nombre. De plus, les molécules constituant la substance /corps ne sont pas statiques: elles sont elles-mêmes mobiles - les atomes tournent, interagissant les uns avec les autres (attirer /repousser).
Caractéristiques de l'eau, son état
La composition d'une substance telle que l'eau (ainsi que sa formule chimique) est connue de tous. Chacune de ses molécules est composée de trois atomes: un atome d'oxygène, désigné par la lettre "O", et des atomes d'hydrogène - le latin "H", dans le nombre2 La forme de la molécule d'eau n'est pas symétrique (semblable à un triangle isocèle).
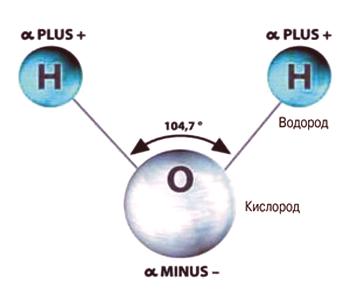
Molécule d'eau
L’eau, en tant que substance, ses molécules, réagit au "milieu" extérieur, aux indicateurs environnementaux - température, pression. Selon ces dernières, l'eau peut changer l'état, il y en a trois:
- L'état naturel le plus habituel de l'eau est le liquide. La structure moléculaire (dihydrol) d'un ordre particulier dans lequel des molécules uniques remplissent (par des liaisons hydrogène) des vides.
- L'état de la vapeur, dans lequel la structure moléculaire (hydrol) est représentée par des molécules simples entre lesquelles des liaisons hydrogène ne sont pas formées.
- L’état solide (la glace elle-même) a une structure moléculaire (trihydrol) avec des liaisons hydrogène fortes et stables.
Outre ces différences, bien sûr, les manières de "passer" d'une substance d'un état (liquide) à un autre diffèrent également. Ces transitions et transforment la substance, et provoquent le transfert d'énergie (libération /absorption). Parmi ceux-ci, on trouve les processus directs - conversion de l’eau liquide en vapeur (évaporation), en glace (gel) et en inversion - en liquide de la vapeur (condensation), de la glace (fonte). En outre, l'état de l'eau - vapeur et glace - peut se transformer: sublimation - glace en vapeur, sublimation - processus inverse.
Spécificité de la glace en tant qu'état d'eau
Il est bien connu que la glace se gèle (transformée à partir d’eau) lorsqu'elle traverse la température dans le sens où elle diminue la limite à zéro degré. Bien que, dansTout cela est un phénomène clair, il y a quelques nuances. Par exemple, l'état de la glace est ambigu, ses types et ses modifications sont différents. Ils diffèrent principalement par les conditions dans lesquelles ils se produisent - température, pression. Il y a déjà quinze modifications de ce type.
La glace, sous ses différentes formes, a une structure moléculaire différente (les molécules ne peuvent être distinguées des molécules d’eau). Glace naturelle et naturelle, dans la terminologie scientifique appelée glace Ih - une substance à structure cristalline. C'est-à-dire que chaque molécule entourée de quatre «voisins» (la distance entre tous est égale) crée la forme géométrique d'un tétraèdre. D'autres phases de glace ont une structure plus complexe, par exemple la structure hautement ordonnée de la glace trigonale, cubique ou monoclinique.
Les principales différences entre la glace et l’eau au niveau moléculaire
Le premier, qui n’est pas directement lié à la structure moléculaire de l’eau et de la glace, est la différence qui existe entre eux - un indicateur de la densité d’une substance. La structure cristalline inhérente à la glace, une fois formée, contribue à une diminution simultanée de la densité (d’un indicateur de presque 1 000 kg /m³ à 916,7 kg /m³). Cela stimule une augmentation de volume de 10%.
La principale différence entre la structure moléculaire de ces états d'agrégation de l'eau (liquide et solide) dansest la quantité, le type et la force des liaisons hydrogène entre les molécules . Dans la glace (à l'état solide), elles combinent cinq molécules et les liaisons hydrogène proprement dites sont plus fortes.
Les molécules des substances de l'eau et de la glace, comme mentionné précédemment, sont les mêmes. Mais un atome dans les molécules de glacel'oxygène (pour créer un "réseau" cristallin de la substance) forme des liaisons hydrogène (deux) avec les molécules "voisines".
distingue la substance de l’eau dans ses différents états (agrégative) non seulement la structure de l’arrangement des molécules (structure moléculaire), mais aussi leur mouvement, la force de la relation /attraction entre elles. Les molécules d'eau à l'état liquide sont plutôt faiblement attirées, ce qui garantit la fluidité de l'eau. Dans la glace solide, l’attraction des molécules est la plus forte; leur activité physique est donc faible (elle garantit la constance de la forme de la glace).






