La valence et le degré d’oxydation sont des concepts souvent utilisés en chimie inorganique. Dans de nombreux composés chimiques, la valeur de la valence et le degré d'oxydation de l'élément coïncident, ce qui explique pourquoi les écoliers et les étudiants sont souvent désorientés. Ces concepts ont vraiment quelque chose en commun, mais les différences sont plus significatives. Pour comprendre la différence entre ces deux concepts, il est utile d’en savoir plus.
Information sur le degré d'oxydation
Le degré d'oxydation est une quantité auxiliaire attribuée à l'atome d'un élément chimique ou d'un groupe d'atomes, qui montre comment des paires communes d'électrons sont réparties entre des éléments en interaction.
C'est une valeur auxiliaire qui n'a pas de sens physique en tant que tel. Son essence est simplement expliquée à l'aide d'exemples:
La molécule de sel comestibleNaClest constituée de deux atomes: un atome de chlore et un atome de sodium. Le lien entre ces atomes est ionique. Le sodium a 1 électron sur le niveau de valence, ce qui signifie qu'il a une paire d'électrons commune avec un atome de chlore. Parmi ces deux éléments, le chlore est plus électronégatif (il a la propriété de se mélanger des paires d’électrons à lui-même), alors la seule paire d’électrons commune se déplacera vers lui. Dans le composé, un élément avec une électronégativité supérieure a un état d'oxydation négatif, moins électronégatif, respectivement, positif, et sa valeur est égale au nombre de paires d'électrons communes. Pour la molécule de NaCl considérée, les états d'oxydation du sodium et du chlore vont ressembler à ceci:
+1 -1
NaCl
chlore, avecla paire d'électrons qui y est déplacée est maintenant considérée comme un anion, c'est-à-dire un atome auquel est attaché un électron supplémentaire, et le sodium comme un cation, c'est-à-dire un atome qui donne un électron. Mais lors de l’enregistrement, le degré d’oxydation est d’abord un signe et, dans le deuxième cas, une valeur numérique, et lors de l’enregistrement d’une charge ionique - et inversement.
Le degré d'oxydation peut être défini comme le nombre d'électrons dont un ion positif manque à un atome électron-neutre, ou qui doivent être pris d'un ion négatif pour s'oxyder en un atome. Dans cet exemple, il est évident que l'ion positif de sodium dû au déplacement de la paire d'électrons manque d'électron et que l'ion chlore a un électron supplémentaire.
Le degré d'oxydation d'une substance (pure) simple, quelles que soient ses propriétés physiques et chimiques, est égal à zéro. La molécule O2 , par exemple, consiste en deux atomes d'oxygène. Ils ont les mêmes valeurs d'électronégativité, de sorte que les électrons communs ne se déplacent pas vers aucun d'entre eux. Cela signifie que le couple d'électrons est strictement compris entre les atomes, car le degré d'oxydation sera nul.
Pour certaines molécules, il est difficile de déterminer où les électrons se déplacent, surtout s’il contient trois éléments ou plus. Pour calculer le degré d'oxydation dans de telles molécules, vous devez utiliser quelques règles simples:
- Un atome d'hydrogène a presque toujours un état d'oxydation constant de +1 ..
- Pour l'oxygène, cet indicateur est -2. Les seules exceptions à cette règle sont les oxydes de fluorure .
+2 -1 +1 -1
OF2et O2F 2 ,
Le fluor étant l’élément ayant l’électronégativité la plus élevée, il déplace donc toujours les électrons qui interagissent vers lui-même. Selon les règles internationales, l'élément avec une valeur électriquement négative inférieure est enregistré en premier, car l'oxygène est en premier lieu dans ces oxydes.
- Si nous résumons tous les états d'oxydation d'une molécule, nous obtenons zéro.
- Un état d'oxydation positif est caractéristique des atomes de métal.
Lors du calcul des états d'oxydation, il convient de rappeler que le plus grand état d'oxydation d'un élément est égal au nombre de son groupe et que le minimum est le nombre du groupe moins 8. Pour le chlore, le maximum d'oxydation est de +7, car il se situe dans le 7ème groupe et le minimum est de 7 -8 = -1. 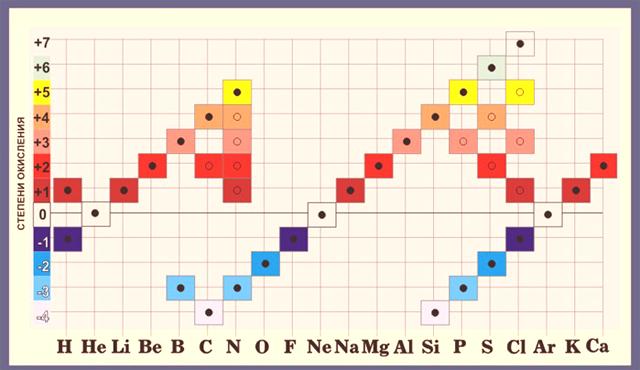
Renseignements généraux sur la valence
La valence est le nombre de liaisons covalentes qu'un élément peut former dans différents composés.
Contrairement au degré d'oxydation, le concept de valence a une réelle signification physique.
La valence la plus haute est égale au numéro du groupe dans le tableau périodique. Le soufre S est situé dans le 6ème groupe, c'est-à-dire que sa valence maximale est de 6. Mais il peut également être de 2 (H2S) ou de 4 (SO2 ).
Presque tous les éléments sont caractérisés par une valence variable. Cependant, il existe des atomes pour lesquels cette valeur est constante. Ceux-ci incluent les métaux alcalins, l'argent, l'hydrogène (leur valence est toujours 1), le zinc (toujours 2), le lanthane (la valence 3). 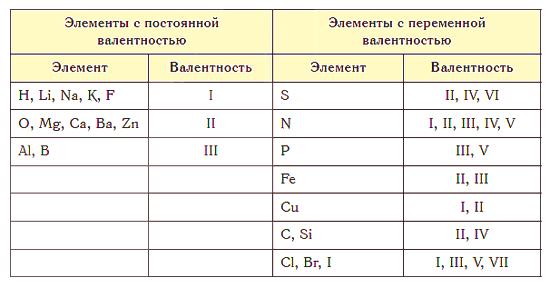
Qu'est-ce qui est commun à la valence et à l'oxydation
- Pour faire référence aux deux, etles autres valeurs utilisent des entiers positifs, écrits au-dessus de la désignation latine de l'élément.
- La plus haute valence, comme le plus grand degré d'oxydation, coïncide avec le numéro de groupe de l'élément.
- Le degré d'oxydation de tout élément d'un composé complexe coïncide avec la valeur numérique de l'un des indicateurs de valence. Par exemple, le chlore, appartenant au 7ème groupe, peut avoir une valence de 1, 3, 4, 5, 6 ou 7, ce qui signifie que les degrés possibles d’oxydation sont ± 1, + 3, + 4, + 5, + 6, + 7.
Les principales différences entre ces concepts
- Le concept de "valence" a une signification physique et le degré d'oxydation est un terme auxiliaire qui n'a aucune signification physique réelle.
- Le degré d'oxydation peut être nul, supérieur ou inférieur à zéro. La valence est strictement supérieure à zéro.
- La valence affiche le nombre de liaisons covalentes et le degré d'oxydation, c'est-à-dire la distribution des électrons dans le composé.







