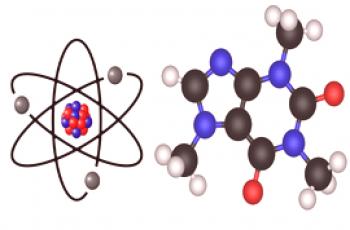
Les atomes et les ions sont des particules microscopiques composées d'un noyau et d'électrons en orbite autour de lui. La principale différence, mais non la seule, entre ces particules est que l’ion porte une certaine charge, mais pas l’atome.
Informations générales sur les atomes et les ions
Un atome est la plus petite particule d'une substance possédant toutes ses propriétés. Le rayon d'un atome est mesuré en picomètres (mètres). Un atome est électriquement neutre, c’est-à-dire une structure non porteuse de charges constituée d’un noyau et d’électrons en rotation autour de lui. Le noyau d'un atome est constitué de protons et de neutrons, également appelés particules subatomiques. Un proton porte une charge positive de magnitude égale à la charge d'un électron. Les neutrons sont gratuits. Le nombre d'électrons dans un atome correspond au nombre de protons dans le noyau, ce qui rend l'atome dans son ensemble électriquement neutre.
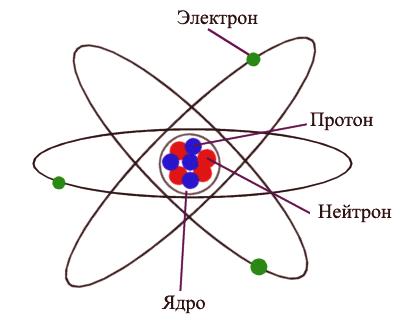
Atome
Un ion est une particule non élémentaire portant une charge positive ou négative. Un ion est produit en train de détacher ou d'attacher un électron à un atome ou à un groupe d'atomes. Un ion avec une charge négative (un atome avec un excès d'électrons) est appelé un anion et un ion qui porte une charge positive (un atome avec un manque d'électrons) est appelé un cation.
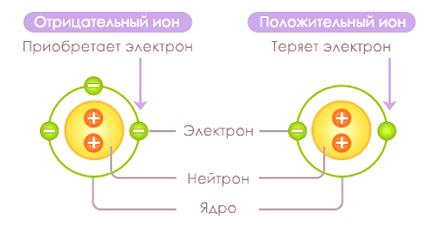
Ions
Comment se passe la formation des ions
Un ion est formé à partir d'un atome dans un processus appeléionisation . Un cation se forme lorsqu'un électron dans un atome reçoit de l'énergie d'ionisation, ce qui lui permet de surmonter une barrière de potentiel et de s'éloigner de l'atome, surmontant ainsi les forces d'attraction électrostatique. Processus d'éducationL'anion se produit avec la libération d'énergie lorsqu'un atome reçoit un électron supplémentaire.
L'ionisation peut survenir en raison d'une augmentation de la température, d'une exposition à un champ électrique, de rayons X ou d'un éclairage.
Ionisation des gaz
Certains atomes ne forment pas d'ions négatifs. Par exemple, les gaz inertes dus à un niveau d'électrons externe complètement complété ne peuvent pas attacher un autre électron. Les gaz inertes ne réagissent pas avec d'autres substances dans des conditions normales. L'énergie d'ionisation des gaz inertes est très élevée par rapport aux atomes d'autres éléments chimiques - de 10,8 eV pour le radon à 24,6 eV pour l'hélium. Une telle valeur de l’énergie d’ionisation complique la formation d’ions de gaz inerte.
Tous les métaux alcalins (rubium, sodium, potassium, lithium, césium, France) sont de bons agents réducteurs, c’est-à-dire qu’ils donnent facilement des électrons à d’autres atomes, se transformant en ions chargés positivement. Cela se produit en raison de la faible énergie d'ionisation - jusqu'à 5 eV. Francius est le restaurateur le plus puissant. Les atomes de cet élément donnent des électrons plus facilement que d'autres, en raison de la très faible énergie d'ionisation. Les métaux alcalins n'ont qu'un électron de valence, et il est plus facile de céder que d'attacher sept électrons pour compléter le niveau d'énergie. Les métaux alcalins peuvent se transformer en ions chargés positivement simplement par exposition à la lumière.
L'hydrogène a une propriété similaire. Son atome a un seul électron et le cède facilement, formant un cation.
Les halogènes - le fluor, le brome, l’iode, le chlore et l’astatine (éléments du sous-groupe principal du 7ème groupe du tableau périodique des éléments) ont une électronégativité élevée - la propriété de décaler les paires d’électrons communes du composé. Ils forment facilement des anions car sur le niveau extérieur, ils ont déjà 7 électrons et un seul manque pour compléter le niveau. Le brome, le chlore, l'iode et l'astatine peuvent former des ions négatifs et positifs au contact d'éléments plus électronégatifs. Le fluor ne forme jamais d'ions positifs puisqu'il s'agit de l'élément à l'électronégativité la plus élevée et à la haute énergie d'ionisation.
Qu'est-ce qui est commun entre l'atome et l'ion?
Un atome et un ion du même élément ont le même nombre de protons et de neutrons dans le noyau.
Un ion est désigné par le même symbole que l'élément chimique correspondant dans le tableau périodique des éléments, seule la valeur de la charge est indiquée à droite.
Différences entre l'atome et l'ion
La principale différence entre un atome et un ion réside dans le fait que l'ion est une particule chargée et que l'atome n'est pas une particule chargée.
En outre, la masse d’un atome et d’un ion du même élément est différente en raison de la différence de nombre d’électrons. Le cation a une masse inférieure à l'atome du même élément et l'anion, respectivement, est plus grand. La différence entre la masse d'un atome et la masse d'un ion est un multiple de la masse de l'électron.
Contrairement aux atomes, les ions ne possèdent pas les propriétés d'une substance simple. Les cristaux d'iode en sont un exemple. Ils sont bleu foncé à l'état gazeux.violet, et ses ions sont incolores. Les ions d'iode ne donnent pas de réaction colorée avec l'amidon et ne sont pas toxiques, contrairement aux cristaux.
Un exemple similaire est lecuivre . Ce métal a une couleur rouge or et ses ions sont vert-bleu.
Le potassiumest un métal argenté dont les atomes réagissent activement avec l'eau, alors que les ions de cette substance ne possèdent pas cette propriété. La même distinction est caractéristique des propriétés des atomes et des ions sodium.
Le cation hydrogène dans la réaction avec l'ammoniac forme l'ion ammonium. Pour une molécule d'hydrogène, cette réaction n'est pas typique.
Contrairement aux ions, les atomes ne se retrouvent pas dans la nature. Les seules exceptions sont les gaz inertes, qui ne réagissent avec d'autres éléments que dans des conditions extrêmes. Si un ion est formé de plusieurs atomes, sa taille et sa structure sont significativement différentes de celles d'un atome. Contrairement à un atome, un ion n'appartient pas à des particules élémentaires.
Les ions ont un niveau d'énergie externe complet - ils contiennent 8 électrons. Aucun atome autre que les gaz inertes ne possède cette propriété.