Les solutions dispersées sont des systèmes dans lesquels la phase est représentée par des particules dont la taille varie de 1 nm à 10 microns. Les systèmes de dispersion sont courants, utilisés dans l'industrie. Ceux-ci comprennent: les aérosols (gouttelettes ou particules solides en suspension dans l’air), les émulsions (les gouttelettes liquides dissoutes dans un autre liquide), les solutions colloïdales sont des sols (systèmes hétérogènes à deux phases dont la taille des particules se situe entre les émulsions et les solutions vraies, puis est compris entreet 1 (entre 1 et 100 nm) . Les particules dispersées peuvent se trouver dans un état global diversifié. L’ensemble des particules est une phase et leur combinaison est un milieu dispersé (liquide, gazeux et solide).
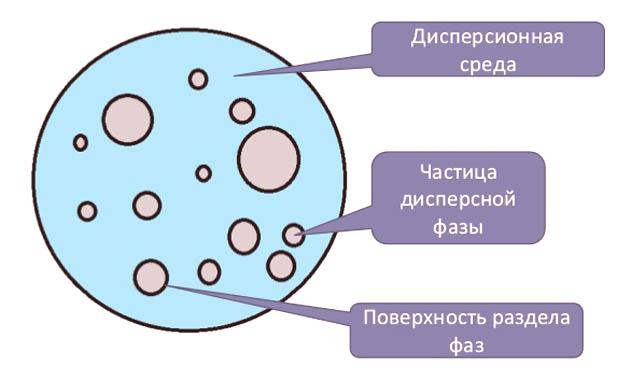
La composition du système dispersé
Propriétés et utilisation de solutions colloïdales
Au sens large, les colloïdes sonttous les organismes naturels et plantes environnementales , dont la plupart sont pris avec des aliments dans un état colloïdal. Les médicaments, certaines peintures et même les matériaux de construction (liants de ciment et de béton, peintures et céramiques, matériaux combustibles, fibres artificielles, plastiques) sont également appelés colloïdes.
Propriétés cinétiques de systèmes dispersés hétérogènes. Le mouvement est dû à la différence de taille des particules. Une suspension mince capable d'un mouvement aléatoire brownien. Par exemple, de la graisse ajoutée à de l'eau ou du lait dilué avec de l'eau. Le mouvement des particules d'une solution colloïdale est thermodynamique et énergivore.

autresLa propriété cinétique des solutions est la diffusion: le processus de déplacement des particules dû aux différences de concentration. Mais les particules grossières solides ne participent pas au mouvement chaotique, mais la raison principale de leur mouvement est la séparation de la densité des phases dans un milieu dispersé. Par conséquent, si la densité est supérieure, les particules se déposent progressivement sous l’effet de la gravité - un processus de sédimentation. Un processus très courant utilisé dans la chimie moléculaire des protéines, des molécules d'acide nucléique et même des bactéries. La pression osmotique des colloïdes est très faible, car le colloïde a une masse importante.

Les propriétés optiques de la solution sont dues à la capacité deà diffuser la lumière , c'est-à-dire à la présence du phénomène d'opalescence (dû à une inhomogénéité optique). On observe que si vous passez un faisceau de lumière à travers une cuvette en plaçant une lentille devant vous, vous pouvez voir l’effet de côté (cône de Tyndall). Cela est dû à la dépendance de la taille des particules de la solution et de la longueur du faisceau lumineux.
On observe une dispersion si la longueur d'onde est supérieure à la taille des particules dans le p-re. Si les particules ont la même taille que la longueur d'onde, le faisceau l'arrondit droit et se disperse, c'est-à-dire qu'un phénomène de diffraction est observé. En raison du spectre de diffusion, il est possible de déterminer avec précision si la solution est vraie (solution ionique, moléculaire ou colloïdale).
Les solutions vraies et leurs propriétés
Les solutions vraies sont des solutions transparentes et homogènes à phase solide dispersée dont les particules ont une taille inférieure à un nanomètre.la séparation de phase en solution disparaît. Les solutions vraies sont divisées en ions, si la phase dispersée est constituée d'ions hydratés (solution de chlorure de sodium ou moléculaire (solution de glucose). L'eau joue un rôle indispensable dans la vie, car tous les ions du corps s'y dissolvent, d'où proviennent tous les processus métaboliques entre les cellules.

Différences entre les colloïdes et les solutions vraies
Premièrement, les solutions vraies sont transparentes et homogènes, les particules de la phase dispersée étant inférieures à un nanomètre. Elles ne sont pas caractérisées pardiffraction ou opalescence , il n’ya pas de cône de Tyndall, c’est-à-dire que les particules sont si petites qu’elles ne sont même pas visibles dans un ultramicroscope. Lors du filtrage, les solutions colloïdales ne traversent pas les filtres en papier et les filtres véritables sont facilement filtrés, ce qui indique les différences entre la taille des particules de la phase dispersée. Les solutions vraies passent à travers les membranes cellulaires. Thermodynamique et instable, stratifié, typique des solutions colloïdales et vrai - ne stratifie pas.
Les vraies solutions peuvent être formées spontanément, sans le coût d’énergie supplémentaire, et la solution colloïdale, au contraire, c’est-à-dire que le bilan énergétique de celles-ci n’est pas stable. Les forces de transformation entre la phase et le milieu pour obtenir de vraies solutions sont assez grandes, elles ne nécessitent donc pas de stabilisateur. Les propriétés mécaniques des solutions sont différentes les unes des autres. Les solutions vraies sont plus durables, car la phase dispersée est stationnaire et forme la structure dans laquelle le milieu est enfermé (par exemple, le tissu osseux).La solution colloïdale est librement dispersée, elle a une fluidité, par conséquent, la concentration de la phase et du milieu sont uniformément répartis (poussière, fumée ou brouillard).